王兴鹏 龚自华
慢性胰腺炎是由于各种原因造成的胰腺组织结构和功能持续性损害,临床主要表现为反复发作的腹痛,内外分泌功能不全如脂肪泻、糖尿病等。在西方国家以慢性酒精中毒为常见病因,而在我国则以胆道疾病长期存在为主要病因。慢性胰腺炎病理特征是胰腺组织纤维化,最近发现,胰腺星状细胞(pancreatic stellate cell, PSC)在胰腺纤维化形成中占据重要地位,为今后慢性胰腺炎的治疗研究进一步拓宽了思路。鉴于慢性胰腺炎致病因素复杂性,病程迁延性,临床表现多变性和早期诊断困难性,其治疗效果常不甚理想。慢性胰腺炎热治疗乃是当前面临的挑战性课题。
疼痛的治疗
影响慢性胰腺炎生活质量的主要临床表现是难以缓解的疼痛。迄今为止,慢性胰腺炎疼痛的病理生理机制尚未完全阐明,因此对于疼痛的治疗未能得到有效的控制,有时甚至是无功而返的。目前的研究认为,慢性胰腺炎的疼痛机制是多因素的,主要涉及胰管和/或胰组织的压力升高、神经损害等因素,因此相应的治疗措施则是针对现有的病理机制(图1)[1,2]。
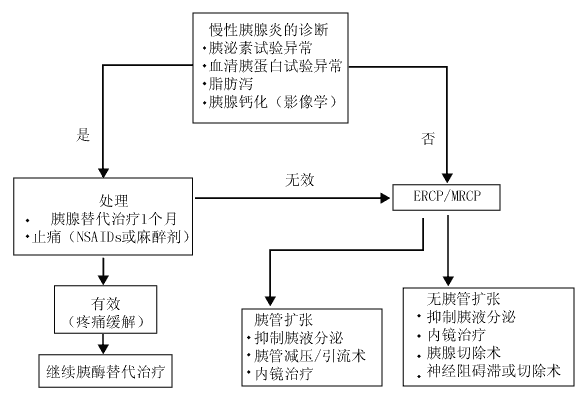
一、 非特异性治疗
大多数慢性胰腺炎患者在疼痛发作时需用止痛剂治疗,常用的止痛剂为非甾体类抗炎药物(NSAIDs)或麻醉剂。但要注意由于长期的止痛易造成麻醉剂的成瘾。患者的疼痛往往有精神病学、心理、社会或身心等因素参与,因而有人主张应用抗抑郁药物。
二、 降低胰腺内压力
胰液分泌的增多、胰管的扩张、胰管的阻塞乃至胰腺组织纤维化及假性囊肿是胰管和/或胰组织压力升高的主要因素,最终导致疼痛的发作,由此提出一系列的针对性治疗措施。
(一) 抑制胰液的分泌
1. 营养支持:慢性胰腺炎时推荐的食物是低脂高碳水化合物,因其对胰腺外分泌的刺激最小。全胃肠道外营养(TPN)能为机体提供营养支持和避免口服,使全胃肠道处于“休息”状态,从而减少胰腺分泌,降低胰管内压力。戒酒对于酒精性慢性胰腺炎患者显得尤为重要。
2. 抑制胃酸分泌:抑制胃酸分泌的理论基础是提高十二指肠腔内的pH,减少酸刺激引起的胰腺外分泌。但至今尚无一项随机双盲的临床研究证明该方法治疗的有效性。由于H2受体拮抗剂或质子泵抑制剂庆用方便、安全,临床上仍广泛应用。
3. 胰酶替代治疗:胰酶制剂缓解慢性胰腺炎疼痛的机制尚不完全清楚,不少理论认为是参与胰腺外分泌的负反馈抑制,可能的机制是由CCK-释放肽(CCK-RP)调控CCK释放介导的[3]。正常情况下十二指肠内的CCK-RP被胰蛋白酶变性,慢性胰腺炎时胰蛋白酶释放减少,致使CCK-RP的变性不充分,使CCK释放增加,后者则促使胰液分泌增加导致胰管压力升高引起胰源性疼痛。胰酶制剂的应用使CK-RP的变性充分,因而减少CCK的释放。不少临床研究业已证实,外源性胰酶制剂使许多慢性胰腺炎患者的疼痛得到缓解。理想的胰酶制剂应具备高酶含量、能耐受胃酸的灭活及在十二指肠碱性环境中迅速释放活性酶成分等特点。值得注意的是在以疼痛为主要症状的慢性胰腺炎患者中,胰酶制剂的成分应以蛋白酶为主,且为非肠溶衣制剂;而当合并有吸收不良时,胰酶制剂的成分则主要为脂肪酶和胰蛋白酶,而无糜蛋白酶的肠溶衣制剂[4]。在一项随机前瞻性双盲研究中,使用非肠溶胰酶片剂可缓解慢性胰腺炎疼痛,而肠溶胰酶制剂则无效[5]。由于胰酶治疗的安全性,1999年美国消化病学会(AGA)推荐其为慢性胰腺炎疼痛治疗的最初药物选择。
4. 奥曲肽:奥曲肽缓解慢性胰腺炎疼痛的机制是奥曲肽可降低血浆CCK水平和抑制胰液分泌,从而减轻胰管内压力而缓解疼痛。欧洲一项研究发现,应用奥曲肽200μg,1次/8h,皮下注射,使65%患者疼痛缓解,而其中31%患者疼痛完全缓解,对照组疼痛缓解率仅为31%[ 6 ]。尚有研究发现,奥曲肽治疗后,假性囊肿体积缩小甚至消失,胰腺间质压力减轻并伴有疼痛的缓解[ 7]。另外也有研究发现,短期使用奥曲肽虽可抑制胰液分泌,但对疼痛的缓解无效,因而提出奥曲肽的应用应是长期大剂量[ 8]。由于奥曲肽的价格贵且注射部位疼痛,使其广泛应用受到限制。
(二) 胰管减压/引流术
胰管减压/引流术主要用于胰管扩张(超过7 mm)的患者,因为胰管的扩张意味着胰管系统和胰实质内压力的升高,此时胰酶制剂常不能缓解疼痛。慢性胰腺炎时胰管扩张、胰管压力和/或胰组织内压力是互为关联的,而压力的增加引起胰腺血流和pH的改变,缺血和H+是引起疼痛的重要刺激因子[ 9]。尽管胰腺内压力改变与疼痛的关系尚存争议,但大多数观点仍认为,胰腺内丈夫力增加与疼痛具有因果关系。胰管引流术应以去除疼痛又能维持胰腺功能为前提。Nealson等[ 10]随访17例慢性胰腺炎患者,39个月后发现,78%患者胰管引流术后胰腺功能无明显变化。统计资料显示,慢性胰腺炎患者应用胰管引流/减压术后,1/3患者疼痛完全缓解,1/3患者疼痛改善,1/3患者疼痛无缓解。
(三) 内镜治疗
对于奥狄氏括约肌功能失调、胰管结石、胰管狭窄和阻塞伴远侧胰管扩张的慢性胰腺炎患者,内镜的干预治疗应为最佳选择。研究证实,胰管狭窄和阻塞与疼痛密切相关。由于胰管狭窄和阻塞、奥狄氏括约肌功能失调使得胰液引流不畅,胰管内压力升高和胰管扩张致使疼痛发生。对于主胰管狭窄的患者,常采用内镜下胰管内置入支架缓解疼痛。最近的研究显示,应用支架扩张治疗使75%慢性胰腺炎患者疼痛缓解,平均随访4.9年,87¥患者获得持续缓解[ 11]。诚然,胰管支架也可引起胰管损伤,再狭窄率高达14%。去除胰管内结石的方法有:内镜下碎石术、奥狄氏括约肌切开通过胰管取石等技术。有报道术后疼痛显著改善,这与病理性胰管扩张的消退相关。疼痛成功缓解与去除结石及以后的胰管直径缩小相关。
(四) 胰腺切除术
对于有疼痛但胰管不扩张、胰腺组织纤维化尤其是钙化的慢性胰腺炎患者,并不适合作引流而应改为胰腺切除术。切除的目的在于消除炎症、纤维化区域及减少胰液的分泌和神经冲动引起的疼痛。一般情况下远侧胰腺切除的效果差,除非病变主要限于胰体及胰尾。远侧 次全切除对疼痛的缓解较为有效,至于胰头近侧切除80年代才广泛应用[ 12]。全胰切除常作为胰腺部分切除失败后的补充。但胰腺切除会导致内、外分泌功能丧失,增加脂肪泻和糖尿病发生的可能性,尤其是全胰切除使胰岛素完全缺失造成极其难治的糖尿病。
三、 减少神经传导
慢性胰腺炎时胰腺神经囊水肿,尤其是神经鞘和神经束膜。损伤的神经鞘不能提供神经和其周围间质组织的屏障,致使产生疼痛的神经递质P物质和钙基因相关肽(CGRP)作用于未保护神经,且神经周围免疫炎症细胞浸润和生长相关蛋白43表达增加,这些可能是疼痛刺激的来源[ 13]。慢性胰腺炎时,胰腺小叶内和小叶间痛觉神经数目增多和直径增大,一暗无天日外界因素如压力、缺血、缺氧或生物活性物质如蛙皮素,前列腺素刺激胰腺的痛觉神经即可产生痛觉,而且慢性胰腺炎时,炎症可降低痛觉神经的痛阈和增加传入到中枢神经系统的信息。对于无明显胰腺形态学改变如假性囊肿、胰管钙化或奥狄氏括约肌狭窄的慢性胰腺炎患者应作神经阻滞术或神经切除术。神经阻滞术应用于慢性胰腺炎的治疗并不多见,最初应用酒精作腹腔神经丛阻滞,但由于酒精能造成不可逆性神经损伤,因而主要用于治疗癌症的疼痛。对慢性胰腺炎患者推荐用类固醇激素注射,一些研究也证实该治疗有一定的疗效[ 14]。最近的研究发现,超声内镜下腹腔神经丛阻滞的效果较CT引导下阻滞持续更久[ 15]。从胰腺出发的感觉神经纤维多穿过腹腔神经节及内脏神经节,因此阻断这些神经节会减轻疼痛。腹腔神经节切除是较常用的手术。内脏疼痛的信号常由交感神经传入中柩神经系统,因此采用手术阻断神经途径来缓解疼痛应主要针对交感神经,神经节后交感神经切除术是基于此应运而生的。最近采用内镜下切除内脏神经,既减少创伤又缩短手术时间,为外科医生所偏爱,比较常用的是腹腔镜下切除内脏神经或切断交感链的联系,经随访有良好的效果[ 16]。
四、 减少胰腺内氧应激
有研究发现,降低胰腺内氧应激可改善慢性胰腺炎的疼痛。McCloy[ 17]在一项双盲安慰剂交叉试验中,给20例患者抗氧化剂(有机硒、胡萝卜素、维生素C、维生素E和甲硫氨基酸)达30周。6例患者用安慰剂后仍有胰腺炎发作,而用抗氧化剂治疗后无1例发作。研究认为,抗氧化剂是缓解慢性胰腺炎的一种安全有效的治疗措施,但对于抗氧化剂治疗可缓解慢性胰腺炎疼痛的有效性尚待今后作进一步研究。
脂肪泻
脂肪泻是慢性胰腺炎时胰腺外分泌功能不全时的主要表现。由于脂肪消化酶的分泌功能减弱或丧失,致使脂肪吸收障碍造成脂肪泻的产生,患者出现消瘦、营养不良及脂溶性维生素缺乏等症状。脂肪泻的治疗首先要注意饮食。另外提高食物中中链三酰甘油的百分比不仅能提供热卡,而且促进脂溶性维生素的吸收和减少脂肪泻。其次,在应用胰酶替代治疗的同时,可加用H2-受体拮抗剂或其它抗酸剂抑制胃酸的分泌,常可增加疗效。
糖尿病
慢性胰腺炎时胰腺内分泌功能不全的表现即是糖尿病,约50%慢性胰腺炎患者发生隐性糖尿病。对于糖尿病的治疗首先要限制糖的摄入,提倡糖尿病饮食。尽量口服降糖药替代胰岛素,因为慢性胰腺炎时常同时存在胰高糖素的缺乏,小剂量的胰岛素也可诱发低血糖的发生。
总之,慢性胰腺炎目前的治疗方案是以控制症状、改善胰腺功能和治疗并发症为重点,强调以个体化治疗为原则的综合治疗。慢性胰腺炎的疼痛治疗首选方法应是无创伤性治疗。发作时可长期使用止痛剂,但要注意麻醉剂的成瘾。某些患者必要时可应用抗抑郁剂治疗。大剂量胰酶 治疗安全方便,应是慢性胰腺炎疼痛和脂肪泻治疗的
 医学常识
医学常识