项目名称:胰岛α与β细胞功能和表型的动态变化在血糖稳态调控中的作用及其机制
项目批准号:81830022
负责人:洪天配
起止时间:2019.1-2023.12
一、项目背景
糖尿病是危害人类健康和生命的重大疾病。据估计,我国成年人中糖尿病患病率约为13%,目前共有1.41亿名成年糖尿病患者。此外,糖尿病患者的知晓率、治疗率及治疗控制率在总人群中均不足50%。这些触目惊心的数据说明我国糖尿病的流行情况和管理现状不容乐观,亟待探索治疗和管理糖尿病的有效策略。
在糖尿病的发生发展过程中,胰岛β细胞功能进行性丧失,最终导致高血糖的恶化和各种并发症的发生。此外,已有研究发现,糖尿病患者往往存在胰高糖素(一种升糖激素)分泌增加,提示胰岛α细胞同样存在功能障碍。因此,探究胰岛α细胞与β细胞功能和表型在糖尿病发生发展中的动态变化有助于阐明糖尿病的发病机制,为糖尿病治疗提供新思路。
功能性β细胞不足是糖尿病发生发展的核心环节之一。1型糖尿病(T1D)因胰岛β细胞大量破坏而导致胰岛素分泌绝对不足。2 型糖尿病(T2D)也存在β细胞功能逐步衰竭的过程,随着病程进展,β细胞总量逐渐减少,导致胰岛素分泌相对不足。因此,恢复功能性胰岛β细胞总量是改善糖尿病长期疗效(甚或治愈糖尿病)的潜在希望,故β细胞再生及其机制研究一直是糖尿病领域的热点和难点。
本项目基于以上背景,在不同代谢条件下明确了胰岛α与β细胞功能和表型动态变化。此外,本项目还探讨了钠-葡萄糖协同转运蛋白2(SGLT2)抑制剂、胰高糖素受体(GCGR)单克隆抗体(单抗)等不同种类药物对胰岛α和β细胞功能和表型的影响,并揭示了潜在分子机制,为研发促进β细胞再生策略提供了新视角。
二、项目主要发现
1、不同代谢条件下胰岛α与β细胞功能和表型变化
由生理状态进展到肥胖进而再到2型糖尿病(T2D)的发病过程中,胰岛β细胞数量、胰岛α细胞功能均经历了代偿性适应到失代偿性变化的转变。当机体发生糖尿病时,β细胞数量降低且发生去分化(即变为功能不成熟的β细胞),α细胞功能障碍、可塑性降低,α与β细胞功能障碍共同参与糖尿病发生发展。
2、GCGR单抗对胰岛α与β细胞功能和表型的影响及其机制
胰岛α细胞分泌的胰高糖素主要通过与GCGR结合发挥生物学作用。胰高糖素的主要靶器官是肝脏,通过促进糖原分解和糖异生,升高血糖水平。因此,阻滞胰高糖素-GCGR信号可以作为一种降糖治疗策略。
本项目研究发现,应用GCGR单抗阻滞胰高糖素-GCGR信号不仅可以降低T1D和T2D小鼠血糖,还可增加β细胞总量、促进胰岛素分泌。应用谱系示踪小鼠,我们发现GCGR单抗促进β细胞原位再生主要通过以下途径:(1)促进β细胞自我复制;(2)诱导α细胞向β细胞转分化;(3)促进胰腺内分泌前体细胞向β细胞分化;(4)抑制β细胞去分化或诱导去分化的β细胞再分化。

图1 GCGR单抗通过四种途径促进糖尿病小鼠β细胞再生
进一步研究发现,β细胞FoxO1介导了GCGR单抗抑制β细胞去分化的作用。基于胰高糖素主要作用于肝脏GCGR,我们的研究还发现GCGR单抗治疗可以促进肝脏成纤维生长因子21(FGF21)产生,进而促进β细胞再生。此外,GCGR单抗治疗可以促进肠道L细胞增殖,增加循环活性GLP-1水平。GLP-1已被证实可以通过抑制食欲、减缓胃排空、促进胰岛素分泌等多种途径参与调控机体糖代谢,以GLP-1为基础的药物已被广泛用于T2D的临床治疗。研究发现,GCGR单抗不仅可以增加肠道来源的GLP-1产生,还可促进胰岛α细胞产生并分泌GLP-1,继而激活β细胞GLP-1受体,诱导β细胞再生。
既往临床试验和动物实验发现,阻滞胰高糖素-GCGR可导致高胰高糖素血症,这一现象曾被认为是GCGR阻滞的“副作用”。然而,我们的研究发现,增加的胰高糖素也可激活GLP-1受体,进而增加β细胞总量。
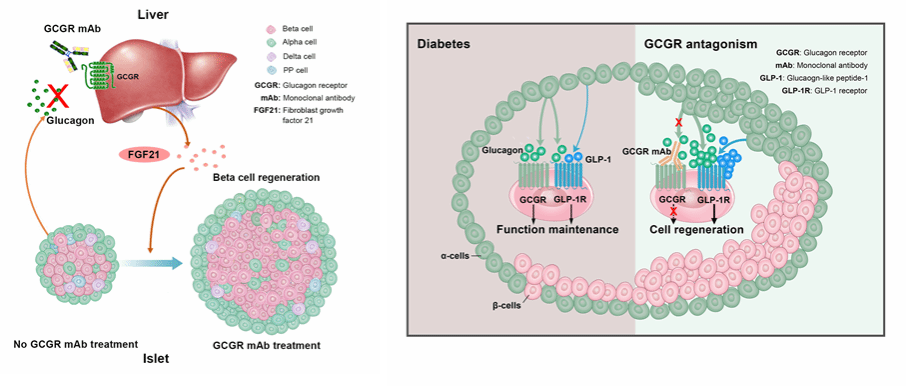
图2 胰腺α细胞胰高糖素–肝脏FGF21轴在β细胞再生中发挥调控作用模式图(左)和胰岛α细胞与β细胞间对话在GCGR阻滞所致的β细胞再生中发挥调控作用模式图(右)
综上所述,GCGR单抗可以通过肝脏-胰腺、肠道-胰腺器官间对话、α-β细胞间交流以及胰岛细胞特定基因从而调控β细胞再生。值得注意的是,与本项目使用的GCGR单抗仅一个氨基酸差异的药物REMD-477(也叫Volagidemab)已顺利完成II期临床试验。研究发现,对目前已经接受胰岛素治疗的糖化血红蛋白不达标的T1D患者,REMD-477可以降低患者HbA1C水平,减少胰岛素日剂量,且未观察到低血糖时间增加,证明其在治疗T1D患者中具有很好的研发前景。本项目研究也为GCGR单抗的临床应用提供了实验依据,为进一步研发促进β细胞再生的治疗策略提供了新视角。
3、SGLT2抑制剂对胰岛胰岛α与β细胞功能和表型的影响及其机制
SGLT2抑制剂是一类新型口服降糖药物,可通过抑制近端肾小管SGLT2,减少葡萄糖的重吸收,增加糖尿排泄,从而降低血糖。本项目研究发现,SGLT2抑制剂同样也可以通过促进β细胞增殖、促进α细胞向β细胞转分化、诱导胰腺前体细胞向β细胞分化、抑制β细胞去分化或诱导去分化的β细胞再分化四种途径促进β细胞再生,为SGLT2抑制剂对β细胞的保护作用提供了新证据。
进一步研究发现,SGLT2抑制剂可重塑肠道菌群,改变氨基酸代谢,进而促进肠道GLP-1产生。此外,实验还证实SGLT2抑制剂可直接作用于α细胞,促进α细胞产生GLP-1,进而激活β细胞GLP-1受体信号通路,促进β细胞再生。本项目研究结果为SGLT2抑制剂的临床应用及促进β细胞再生策略的研发提供了新视角。
综上,本项目研究阐明了不同代谢条件下,胰岛α与β细胞功能和表型的动态变化,明确了β细胞再生的多种途径,探讨了GCGR单抗、SGLT2抑制剂等药理学干预对α与β细胞功能及总量的影响,并深入揭示了器官间对话、α-β细胞间对话以及胰岛细胞特定基因在β细胞再生中的介导作用。本项目有助于阐明糖尿病的发病机制,也为研发促进胰岛β细胞再生的治疗策略提供新思路。
三、项目主要成果
本项目的完成为研发促进β细胞再生的新策略提供实验依据及理论指导。本项目共发表SCI论文22篇,其中Q1区 9篇,中文核心期刊论文14篇。相关研究成果在Diabetologia(封面文章,引用次数Top 1%)、Diabetes(当期highlight)、Metabolism(荣获北京地区最具影响力的学术论文之一)、Diabetes Metab Res Rev(封面文章)、iScience(2篇)、Am J Physiol Endocrinol Metab(当月APS select)等高质量期刊发表。本项目培养研究生8名(其中博士6名、硕士2名),出站博士后2名。其中,1人被评为北京市优秀毕业生,1人毕业论文被评为北京大学优秀博士学位论文,1人获北京市科技新星。项目组成员中有4人获得国家自然科学基金面上项目的资助,3人获得国家自然科学基金青年基金项目资助。本项目组成员参加多次国内外学术会议,进行特邀大会报告或专题发言等20余次,将研究成果进行了推广,加强了在国际和国内的学术影响力。

图3 本项目发表的Diabetologia(左)和DMRR(右)封面文章
四、项目发表代表性学术论文
[1] Cui X#, Feng J#, Wei T, Zhang L, Lang S, Yang K, Yang J, Liu J, Sterr M, Lickert H, Wei R*, Hong T*. Pancreatic alpha cell glucagon-liver FGF21 axis regulates beta cell regeneration in a mouse model of type 2 diabetes. Diabetologia. 2023, 66(3):535-550.
[2] Wei T#, Cui X#, Jiang Y, Yang K, Wang K, Wang D, Li F, Lin X, Gu L, Yang K, Yang J, Hong T*, Wei R*. Glucagon acting at the GLP-1 receptor contributes to β-cell regeneration induced by glucagon receptor antagonism in diabetic mice. Diabetes. 2023, 72(5):599-610.
[3] Le Y#, Yang J#, Li F, Jiang Y, Wei T, Wang D, Wang K, Cui X, Lin X, Yang K, Hong T*, Wei R*. Dapagliflozin improves pancreatic islet function by attenuating microvascular endothelial dysfunction in type 2 diabetes. Diabetes Metab Res Rev. 2023, 39(3): e3607.
[4] Wang K#, Cui X#, Li F, Xia L, Wei T, Liu J, Fu W, Yang J, Hong T, Wei R*. Glucagon receptor blockage inhibits β-cell dedifferentiation through FoxO1. Am J Physiol Endocrinol Metab. 2023, 324(1):E97-113.
[5] Cui X#, Feng J#, Wei T, Gu L, Wang D, Lang S, Yang K, Yang J, Yan H, Wei R*, Hong T*. Pro-α-cell-derived β-cells contribute to β-cell neogenesis induced by antagonistic glucagon receptor antibody in type 2 diabetic mice. iScience. 2022;25(7):104567.
[6] Wei R#, Cui X, Feng J, Gu L, Lang S, Wei T, Yang J, Liu J, Le Y, Wang H, Yang K*, Hong T*. Dapagliflozin promotes beta cell regeneration by inducing pancreatic endocrine cell phenotype conversion in type 2 diabetic mice. Metabolism. 2020; 111:154324.
[7] Wei R#, Gu L#, Yang J, Yang K, Liu J, Le Y, Lang S, Wang H, Thai D, Yan H, Hong T*. Antagonistic glucagon receptor antibody promotes α-cell proliferation and increases β-cell mass in diabetic mice. iScience. 2019; 16:326-339.
 医教研工作
医教研工作