本须知适用于试验用药品在中心药房统一管理的临床试验。CRA在来中心药房工作前,先了解中心药房管理基本情况及各项要求。
一、启动会前需要完成工作
1.临床试验完成机构立项后,CRA即可向中心药房工作人员发送以下文件电子版(邮箱详见附件1),邮件发送主题:临床试验专业+试验机构立项编号+邮件内容,如:血液科2022-001药房电子版文件递交:
(1)试验用药品管理文件,文件清单详见附件2《试验用药品管理文件夹目录》(首次递交时,仅递交标注“√”的文件)
(2)《试验用药品管理信息摘要表》(模板详见附件3)
2.中心药房工作人员审核上述文件,如有问题,通过邮件回复CRA,CRA按照中心药房工作人员要求修改,直至双方确认电子版文件没有问题。
3.CRA于启动会前10个工作日将上述文件的纸质版递交至中心药房,文件夹递交要求:
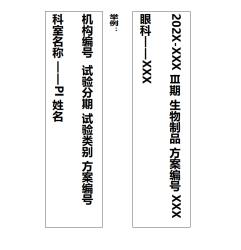
(1)使用两孔文件夹(黑色,厚度5cm左右,内附20-30个数字塑料隔页纸及11孔袋);
(2)文件夹侧签要求如下图:
4.CRA递交纸质文件时,与中心药房老师现场沟通确认如下事宜:
(1)试验用药品管理细节
(2)收集中心药房工作人员简历及GCP证书
(3)根据需求在中心药房百度网盘(下载链接:https://pan.baidu.com/s/1ctF9y7tZCZ2exsodn6GmwA?pwd=8523;)下载温湿度记录仪、温控系统、冰箱校准证书、温度记录
二、确定启动会时间后,CRA通知中心药房工作人员
1.至少提前一周邮件通知中心药房工作人员启动会时间、地点;
2.明确中心药房工作人员授权分工,收集启动会培训记录。
三、试验用药品寄送
1.寄送时间:原则上在启动会后(试验用药品管理文件纸质版已递交、中心药房工作人员已被授权)方可寄送试验用药品。如启动会前寄送,请务必提前完成中心药房工作人员授权分工、收集培训记录;
2.接收联系人:肖奎静/82265531、郭子敬/82265531、李东彦/15611963579。3名中心药房工作人员姓名、联系电话均需体现在快递单上;
3.收件地址:北京市海淀区花园北路49号内科一病区一层 北京大学第三医院药物临床试验机构中心药房 (邮编100191)
4.寄送要求:
(1)请使用正规物流公司或冷链公司;
(2)两种规格或两个品种以上的药品同一批寄送时,装箱清单中每一种试验用药品相关信息独立呈现,信息区分明;
(3)同一批寄送药品达两箱或两箱以上时,每一箱附有相应的装箱清单;
(4)运送途中须有温湿度监测,监测记录可现场直接打印(不接受任何温湿度记录仪数据读取软件安装)
(5)寄送的试验用药品,如该批号药检报告未经备案,请备案后提交药检报告及伦理/机构备案回执,否则不予办理入库手续及IWRS等系统激活操作;
(6)寄送留存单据:
*正规物流公司快递单;
*装箱清单,试验用药品相关信息应涵盖但不限于以下内容:药品名称、药品编号(如有)、规格、批号、有效期、数量等。
四、试验用药品退回申办方
1.试验用药品清点:
(1)退回前,CRA须与中心药房工作人员现场清点核对,实物与记录准确无误,双方签字确认后方可退回
(2)现场清点接待时间为工作日的周一至周五08:00-12:00、13:00-17:00
2.试验用药品退回:
(1) 如为第三方物流取件,取件人凭据“方案编号、试验用药品名称”等相关信息取件
(2) 自备纸箱等运送容器,退回下单时请备注需要纸箱大小尺寸
3.退回信息确认:申办方库房接收退回药品后,请将接收签字之后的清单复印件反馈至中心药房
五、试验用药品监查
1.至少提前1周邮件预约监查时间
2.日常监查接待时间为工作日的周一至周五08:00-12:00、13:00-17:00
3.如为关中心前最后一次监查,预约时请说明
六、试验用药品管理相关文件更新
1.更新的文件需完成伦理备案
2.将伦理备案回执及更新后文件(均为纸质文件)一起递交至中心药房
七、试验用药品管理文件夹归档
1.试验用药结束后,提前进行试验用药品管理文件夹的自查,自查结束后由中心药房工作人员质控,并在《药物临床试验项目结题自查表》附表最后一页签字确认;
2.临床试验资料归档前,提前电话/邮件告知中心药房工作人员归档时间,以便中心药房工作人员提前准备文件夹;
3.临床试验资料归档当天,到中心药房领取药品管理文件夹,同其他临床试验资料一并归档。
 办事指南
办事指南