2024年5月6日,北京大学第三医院(北医三院)内分泌科魏蕊研究员/洪天配教授团队在《分子癌症》(Molecular Cancer)发表关于乳酸化修饰调控胰腺导管腺癌发生发展的研究成果。论文题目为:糖酵解与组蛋白乳酸化之间的正反馈调节可促进胰腺导管腺癌发生发展(Positive feedback regulation between glycolysis and histone lactylation drives oncogenesis in pancreatic ductal adenocarcinoma)。

论文截图
魏蕊研究员/洪天配教授团队长期致力于胰腺代谢异常与疾病之间关系的研究,尤其关注胰岛代谢与糖尿病治疗新靶点,相关研究先后发表在Diabetes(2024封面文章,2023主编重点推荐)、Diabetologia(2023封面文章)、Metabolism等杂志。本研究从胰腺外分泌腺代谢入手,将胰腺外分泌腺代谢异常与表观遗传修饰重塑拓展到胰腺癌研究领域。
胰腺导管腺癌位居中国居民恶性肿瘤相关死亡率第六位,其五年生存率不足10%,预后极差。近年来,尽管国内外学者尝试了多种方法以期改善胰腺导管腺癌患者的预后,但胰腺导管腺癌患者的生存率并未得到明显改善。因此,深入研究胰腺导管腺癌发病机制,寻找新的疾病治疗靶点具有重要意义。
组蛋白乳酸化修饰是2019年新发现的一种组蛋白翻译后修饰类型,研究发现组蛋白乳酸化参与多种疾病的发生发展,包括肿瘤、心血管疾病、神经退行性疾病等。然而,目前尚无研究报道组蛋白乳酸化修饰是否参与胰腺导管腺癌的发生发展。
本研究通过检测胰腺导管腺癌细胞系和患者胰腺导管腺癌组织中的乳酸含量,发现胰腺导管腺癌中存在乳酸的大量堆积,乳酸堆积进一步促进胰腺导管腺癌细胞产生乳酸化修饰。
既往研究表明,组蛋白H3K18乳酸化(H3K18la)在眼黑色素瘤、肾透明细胞癌中高表达。本研究结果显示,H3K18la在胰腺导管腺癌中也呈现高表达,且与患者生存期呈负相关。
随后,研究团队在体内和体外实验中发现,分别利用糖酵解抑制剂干预或敲减乳酸脱氢酶A,可抑制乳酸产生并下调H3K18la水平。组蛋白乳酸化修饰程度的降低不仅可以在体外抑制胰腺导管腺癌细胞系的增殖和迁移,而且可在体内抑制胰腺导管腺癌生长和转移。
既往的研究发现,组蛋白乳酸化可促进基因转录,调控基因表达。因此,研究团队使用CUT&Tag测序、转录组测序联合GEPIA数据库,筛选受H3K18la调控的基因。联合分析结果显示,H3K18la调控基因富集到细胞周期相关通路,且差异表达基因主要位于细胞周期M期。因此,本研究最终聚焦于H3K18la对M期上游基因TTK和BUB1B的调控作用。
研究团队通过ChIP-qPCR、RT-qPCR及western blot分析,证实了H3K18la可调控TTK和BUB1B的表达。本研究及其他研究均证实,TTK和BUB1B本身在胰腺癌中呈现高表达。此外,本研究还发现,这两个基因的表达水平越高,患者总生存期和无病生存期越短。在胰腺导管腺癌细胞系中,敲减TTK和BUB1B可抑制肿瘤细胞增殖和迁移,而过表达TTK则可部分逆转糖酵解抑制剂对胰腺导管腺癌细胞增殖和迁移的抑制作用,进一步证实了H3K18la对TTK的正向调控作用。
研究团队发现,组蛋白乙酰化酶P300和去乙酰化酶HDAC2可分别作为胰腺导管腺癌细胞中组蛋白乳酸化的乳酸化酶和去乳酸化酶,而敲减TTK和/或BUB1B可进一步抑制P300的表达,提示TTK/BUB1B可反馈调控组蛋白乳酸化过程。此外,本研究还发现,TTK作为一种双特异性激酶,可磷酸化乳酸脱氢酶A的酪氨酸239位点,进一步影响酶活性、乳酸产生及组蛋白乳酸化水平。
上述机制研究结果提示,H3K18la下游靶基因可反馈调控糖酵解和组蛋白乳酸化修饰,从而在胰腺导管腺癌细胞中形成正反馈环路,促进肿瘤发生发展。
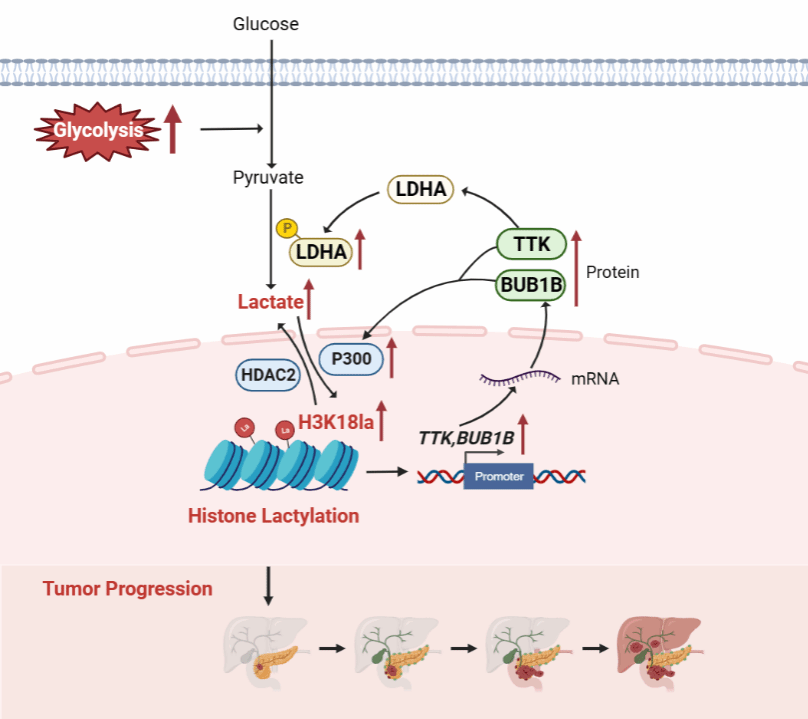
糖酵解-H3K18乳酸化-TTK/BUB1B环路参与胰腺导管腺癌发生发展的模式图
本研究首次揭示了组蛋白乳酸化(尤其是H3K18la)参与介导胰腺导管腺癌的发生发展,明确了糖酵解-H3K18la-TTK/BUB1B正反馈调控环路在胰腺导管腺癌发生发展中的重要作用,为研发胰腺导管腺癌治疗新策略、开发药物作用新靶点提供理论基础。
北医三院内分泌科博士生李菲、检验科副研究员司文喆及内分泌科博士生夏利为共同第一作者,内分泌科魏蕊研究员和洪天配教授为共同通讯作者。本研究得到国家自然科学基金等课题经费的支持。
原文链接:https://doi.org/10.1186/s12943-024-02008-9
共同第一作者

李菲
北京大学第三医院
内分泌科2022级博士研究生
主要研究方向:糖代谢与胰腺功能调控

司文喆
北京大学第三医院
检验科副研究员
硕士研究生导师
主要研究方向:生物化学与分子生物学检验、恶性肿瘤的表观遗传调控机制
点击了解更多

夏利
北京大学第三医院
内分泌科2023级博士研究生
主要研究方向:胰岛再生与胰岛功能调控
并列通讯作者

魏蕊
北京大学第三医院
内分泌科研究员
博士生导师
主要研究方向:胰岛再生及糖尿病治疗新靶点
点击了解更多

洪天配
北京大学第三医院
内分泌科主任
教授、主任医师、博士生导师
主要研究方向:糖尿病基础与临床研究、干细胞分化研究等
点击了解更多
参考文献
1. 郑荣寿, 陈茹, 韩冰峰, 王少明, 李荔, 孙可欣等. 2022年中国恶性肿瘤流行情况分析[J]. 中华肿瘤杂志, 2024,46:221-31.
2. Encarnación-Rosado J, Kimmelman AC. Harnessing metabolic dependencies in pancreatic cancers. Nat Rev Gastroenterol Hepatol. 2021;18:482-92.
3. Zhang D, Tang Z, Huang H, Zhou G, Cui C, Weng Y, et al. Metabolic regulation of gene expression by histone lactylation. Nature. 2019;574:575-80.
4. Yu J, Chai P, Xie M, Ge S, Ruan J, Fan X, et al. Histone lactylation drives oncogenesis by facilitating m(6)A reader protein YTHDF2 expression in ocular melanoma. Genome Biol. 2021;22:85.
5. Xie B, Lin J, Chen X, Zhou X, Zhang Y, Fan M, et al. CircXRN2 suppresses tumor progression driven by histone lactylation through activating the Hippo pathway in human bladder cancer. Mol Cancer. 2023;22:151.
6. Wang N, Wang W, Wang X, Mang G, Chen J, Yan X, et al. Histone Lactylation Boosts Reparative Gene Activation Post-Myocardial Infarction. Circ Res. 2022;131:893-908.
7. Pan RY, He L, Zhang J, Liu X, Liao Y, Gao J, et al. Positive feedback regulation of microglial glucose metabolism by histone H4 lysine 12 lactylation in Alzheimer's disease. Cell Metab. 2022;34:634-48.e6.
8. Yang J, Luo L, Zhao C, Li X, Wang Z, Zeng Z, et al. A Positive Feedback Loop between Inactive VHL-Triggered Histone Lactylation and PDGFRbeta Signaling Drives Clear Cell Renal Cell Carcinoma Progression. Int J Biol Sci. 2022;18:3470-83.
9. Kaistha BP, Honstein T, Müller V, Bielak S, Sauer M, Kreider R, et al. Key role of dual specificity kinase TTK in proliferation and survival of pancreatic cancer cells. Br J Cancer. 2014;111:1780-7.
10. Grützmann R, Pilarsky C, Ammerpohl O, Lüttges J, Böhme A, Sipos B, et al. Gene expression profiling of microdissected pancreatic ductal carcinomas using high-density DNA microarrays. Neoplasia. 2004;6:611-22.