近日,北京大学第三医院肿瘤中心、医学创新研究院基础医学研究中心与妇产科研究团队联合在Science China Life Sciences杂志上在线发表了题为“靶向卵巢癌LTA4H促进CCL5介导的免疫微环境重塑,并提高顺铂治疗敏感性”(Targeting LTA4H facilitates the reshaping of the immune microenvironment mediated by CCL5 and sensitizes ovarian cancer to Cisplatin)的研究成果。该研究建立了基于多不饱和脂肪酸(PUFA)代谢基因的卵巢癌预后预测模型,并揭示其中关键基因LTA4H的肿瘤免疫调节功能。

卵巢癌是最具致命性的妇科肿瘤,具有侵袭性高、诊断晚、复发率高等特点。卵巢癌中脂质代谢的多种代谢酶表达异常,导致代谢紊乱。花生四烯酸(AA)是PUFA代谢的特征性途径,AA的代谢物不仅参与免疫细胞功能和炎症的调节,还参与调控卵巢癌发生和进展。
考虑到PUFA代谢在卵巢癌发生发展中可能发挥重要作用,本研究利用公共数据集建立了基于卵巢癌PUFA相关基因表达的10基因预后预测模型。该模型具有较强的鲁棒性,在不同平台的数据集(TCGA、ICGC、GSE17260)中能起到稳定的预测作用。不同风险亚组与临床特征之间的相关性证明了模型的良好性能。利用临床组织样本进行验证,发现模型中的关键基因LTA4H的高表达提示卵巢癌患者的不良预后,并与CD8+细胞浸润减少及CD11b+细胞浸润增加相关。体外及体内实验表明,靶向LTA4H可增强卵巢癌对顺铂的敏感性,重塑免疫细胞浸润特征。此外,该研究发现LTA4H/DNMT1/CCL5调控轴可能参与了LTA4H对卵巢癌免疫微环境的调控作用。
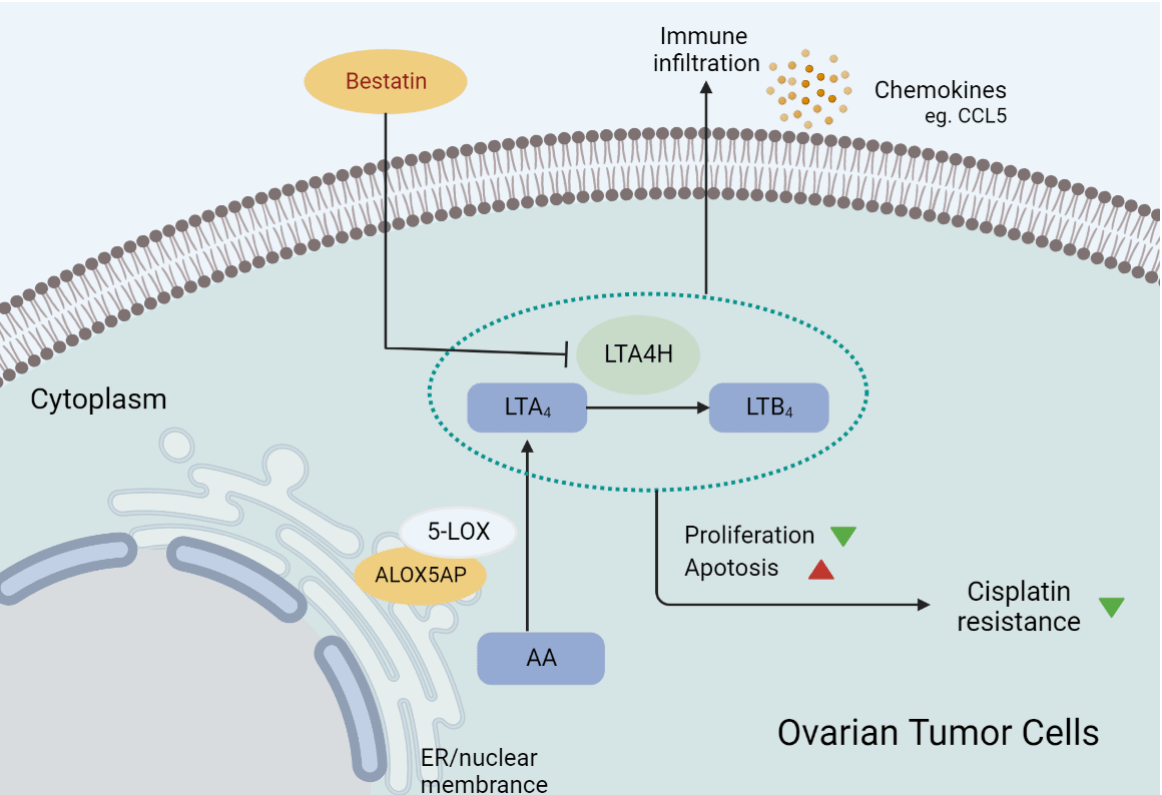
本研究提出了一种基于PUFA代谢基因的卵巢癌患者预后预测模型,并筛选出关键代谢靶点LTA4H,发现了其对于肿瘤细胞生长及免疫微环境的调控作用,为LTA4H作为一种卵巢癌治疗的潜在靶点提供了新的线索。
北京大学第三医院肿瘤中心、医学创新研究院基础医学研究中心的郭正阳、黄架旗、霍霄为该文章的第一作者,薛丽香、杨建岭和妇产科郭红燕为通讯作者。该研究成果得到国家自然科学基金和北京市自然科学基金等项目的资助。
 科室动态
科室动态