组蛋白甲基转移酶EZH2作为公认的癌基因,在多种实体瘤中广泛高表达,被认为是具有良好抗癌潜力的治疗靶点。然而,EZH2抑制剂在实体瘤中疗效不佳。在结肠癌中,抑制EZH2活性可上调PD-L1表达,促使肿瘤发生免疫逃逸,从而削弱EZH2抑制剂的抗肿瘤疗效。因此,需要寻找EZH2对PD-L1调控的内在机制,以期进一步在结肠癌实现协同抗癌的目的。
近日,北京大学第三医院医学创新研究院基础医学研究中心联合普外科、肿瘤放疗科等多科室在Advanced Science发表了题为“EZH2 Inhibition Enhances PD-L1 Protein Stability Through USP22-Mediated Deubiquitination in Colorectal Cancer”的研究论文,揭示了EZH2抑制剂通过表观遗传方式上调去泛素酶USP22表达,增强结肠癌PD-L1蛋白稳定性并与免疫治疗发挥协同抗肿瘤效应的内在机制。

该研究发现,在结直肠癌中,EZH2可通过泛素-蛋白酶体系统增强PD-L1在蛋白水平的稳定性,抑制EZH2活性可通过经典组蛋白H3K27me3方式,转录激活去泛素化酶USP22表达,并进而增强USP22介导的PD-L1的去泛素化,从而延长PD-L1蛋白半衰期并增强其稳定性。EZH2抑制剂可抑制结肠癌抗肿瘤免疫,增加Treg趋化和TIM-3+ 晚期耗竭CD8+细胞毒性T细胞浸润,敲减肿瘤USP22可降低结肠癌PD-L1表达,改善肿瘤免疫微环境并增强EZH2抑制剂Taz治疗的敏感性。该联合团队通过对公共数据库的挖掘,证实USP22可作为结肠癌患者预后预测因素,并可预测患者肿瘤免疫浸润状态。该研究对PD-L1的内在调控机制进行了完善补充,首次发现EZH2介导的肿瘤表观遗传对PD-L1存在蛋白水平调控,鉴定并验证出介导这一效应的EZH2新靶点USP22。该研究探索了表观遗传与免疫治疗发挥协同抗肿瘤效应的可能性,为表观遗传药物及免疫治疗的临床应用拓展及联合应用提供了新的支持证据。
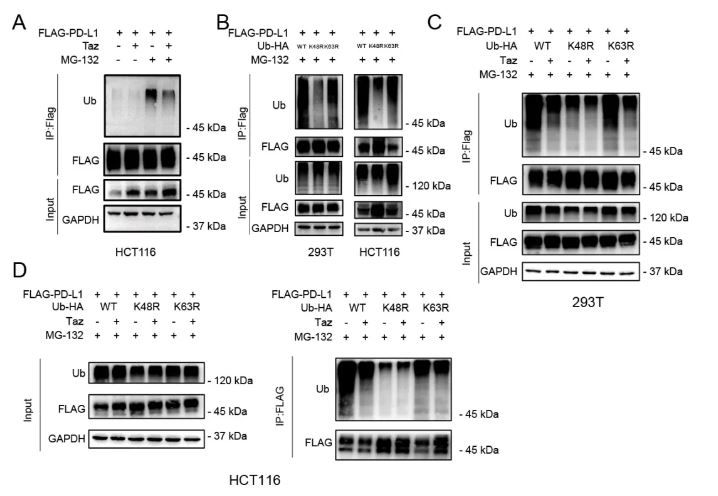
图1. EZH2抑制剂可通过减少PD-L1的K48-泛素化修饰,增强PD-L1蛋白稳定性
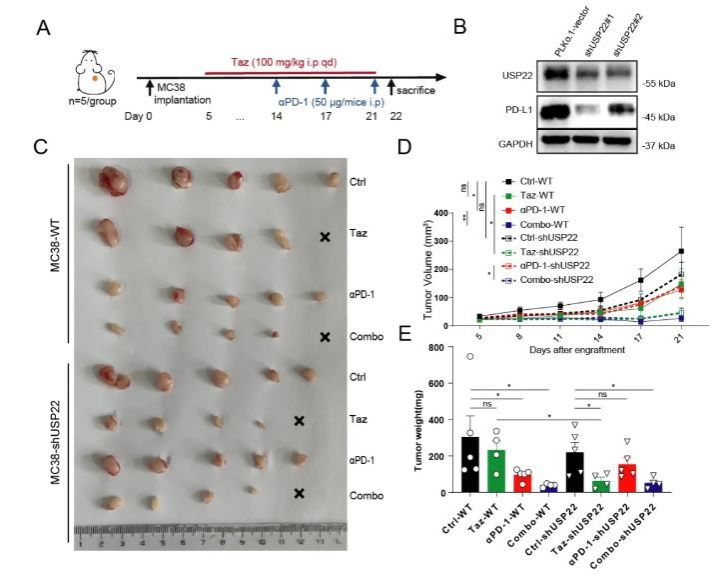
图2. EZH2抑制剂联合抗PD-1免疫治疗可在结肠癌体内模型中发挥协同抗癌效应
北京大学第三医院肿瘤中心、医学创新研究院基础医学研究中心的黄架旗、殷倩倩、王羽晴和普外科周鑫为该文章的共同第一作者,薛丽香、杨建岭和肿瘤放疗科王皓为通讯作者。该研究得到了国家重点研发计划,国家自然科学基金和北医三院基金项目的支持。
 科室动态
科室动态