2019年上半年机构对原有3个部门:机构办公室、质量管理部、中心药房的职责进行了重新梳理及优化,改组为运营部,主要负责机构的日常工作、全院注册药械临床试验管理、CRC管理、中心药房运营、GCP培训等。现有全职员工8人。

持续优化流程,提高启动效率
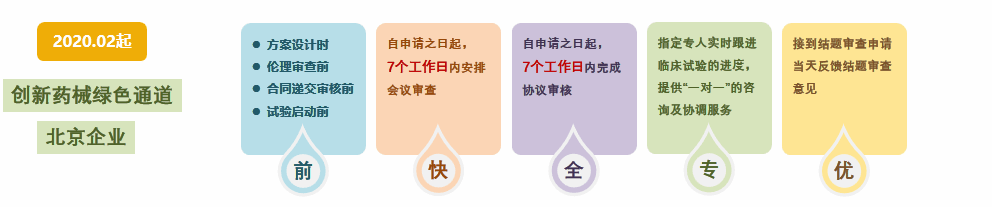
2019年我院实行临床试验立项前置审查管理模式,机构立项、伦理审查、人类遗传资源管理、协议审核同步推进,将临床试验启动时间缩短1-2个月。2020年制定了《一档创新药械及北京市企业发起的临床试验实施保障方案》:1日内完成临床试验立项,7日内完成伦理审查和人类遗传资源的联动审核,10日内完成临床试验协议的院内审核及签署;并建立临床试验专家技术团队服务前置、伦理委员会加速审查、合同管理部门加速审核、机构“一对一”服务模式,进一步缩短临床试验启动时间。
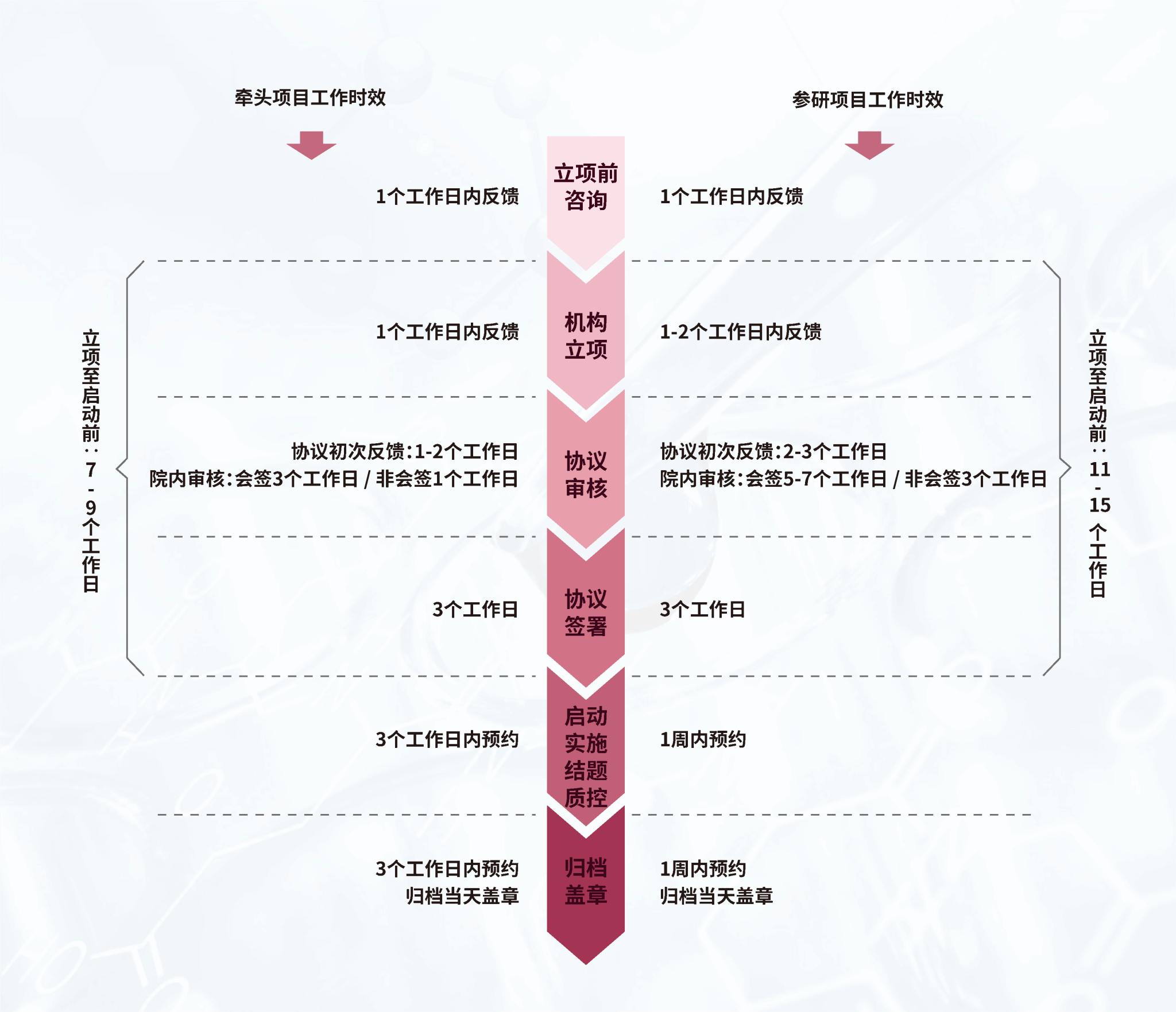
2022年机构的平均工作效率汇总如下:立项资料初次反馈用时1.64工作日,递交立项资料至完成立项用时7.03个工作日;协议审核初次反馈用时3.42个工作日,使用协议模板的协议定稿用时10.6个工作日,未使用协议模板的协议定稿用时17.2个工作日,递交纸质协议至生效用时3.25个工作日。工作效率较往年均有不同程度提升。
绿色通道保障方案
助力牵头项目提质增效
2022年机构运营部与伦理综合办公室联动,探索多中心牵头项目伦理、机构、科室、申办方高质高效合作模式,助力牵头试验提质增效。机构可在临床试验前期参与产品研发策略制定、方案设计及撰写、ICF修改、研究团队培训;试验启动阶段安排专人参加项目启动会,现场沟通试验流程、风险环节;试验实施阶段定期召开质量分析会,把好试验质量关。目前机构提供支持的牵头项目,从立项到启动仅用59个自然日。
牵头及参研项目工作时效
临床试验质量管理
机构运营部采用“基于风险”的质量管理理念,应用信息化技术,运用标准化指标,与培训相结合,从临床试验数据产生的源头控制临床试验质量,提升研究团队临床试验整体能力。对外聘研究协调员(CRC)进行全方位评估,加强其规范化管理及专业培训,有效提升我院CRC服务质量和效率。在历次临床试验数据现场核查中,我院临床试验质量均获得药监部门、同行及申办方的高度认可。
试验用药品中心化管理
临床试验中心药房建立于2012年12月,是负责全院临床试验用药品集中管理的技术服务平台,拥有专业化、标准化、流程化、系统化管理体系,从源头保障了全院临床试验的质量,获得了研究者、申办者、药监部门的高度认可。2015年至2018年连续四年举办“临床试验中心药房建设与管理”国家级继续教育项目培训班,吸引了全国187家兄弟单位342名学员参加学习。临床试验中心药房以其标准化/多样化技术服务模式在国内行业起到引领作用,并获得全国首家“临床研究药物中心化管理项目示范单位”称号。

 部门简介
部门简介