近日,北京大学第三医院运动医学研究所敖英芳教授课题组在生物医学1区杂志《Theranostics》(2020 IF: 8.579)上发表论文,首次报道了钙黏素蛋白Cadherin-11在色素沉着结节性滑膜炎(PVNS)发病过程中协同炎症因子促进成纤维样滑膜细胞(FLS)侵袭、迁移及软骨破坏,从而导致PVNS具有高复发、强软骨破坏的能力,进一步揭示了PVNS的发病机制,为PVNS的分子生物治疗提供新的靶点,有望后续实现临床应用转化。

PVNS是一种发病机制不明具有局部侵袭性生长的关节滑膜病变。PVNS临床症状不典型,大多数患者出现缓慢进行性单关节病变,表现为反复发作的关节出血,肿胀,进而导致关节软骨破坏和功能障碍。临床治疗主要通过切除整个病变滑膜组织以减轻疼痛并降低关节破坏的风险,但由于单纯滑膜切除术后局部复发率很高(21%-50%)术后常常需要进行放射治疗以防复发。此外,PVNS还具有恶变并在身体其他部位引起转移的可能,同时PVNS是炎性疾病还是肿瘤性疾病目前仍有争议,目前缺乏有效的特异性分子治疗靶点。因此,迫切需要探索PVNS的发病机理并寻找新的分子治疗靶标。
本研究首次对PVNS患者关节液进行炎症因子芯片检测,发现IL-β、TNF-α等三十多种炎症因子较对照组显著提高,且参与调控PVNS的增殖、侵袭和复发等疾病特征。同时,研究人员还发现PVNS FLS中较正常滑膜FLS高表达钙黏素蛋白Cadherin-11,该分子作为钙黏素家族成员,特异性在滑膜细胞中表达,本研究发现其表达增高直接促进PVNS FLS的迁移和侵袭能力。进一步研究发现,炎症因子可通过激活PI3K / AKT信号通路上调Cadherin-11的表达,在炎症因子和Cadherin-11的协同作用下,进一步增加PVNS FLS的侵袭和迁移能力。而敲低PVNS FLS中Cadherin-11的表达,或阻断PI3K / AKT信号通路可有效抑制其侵袭和迁移能力。
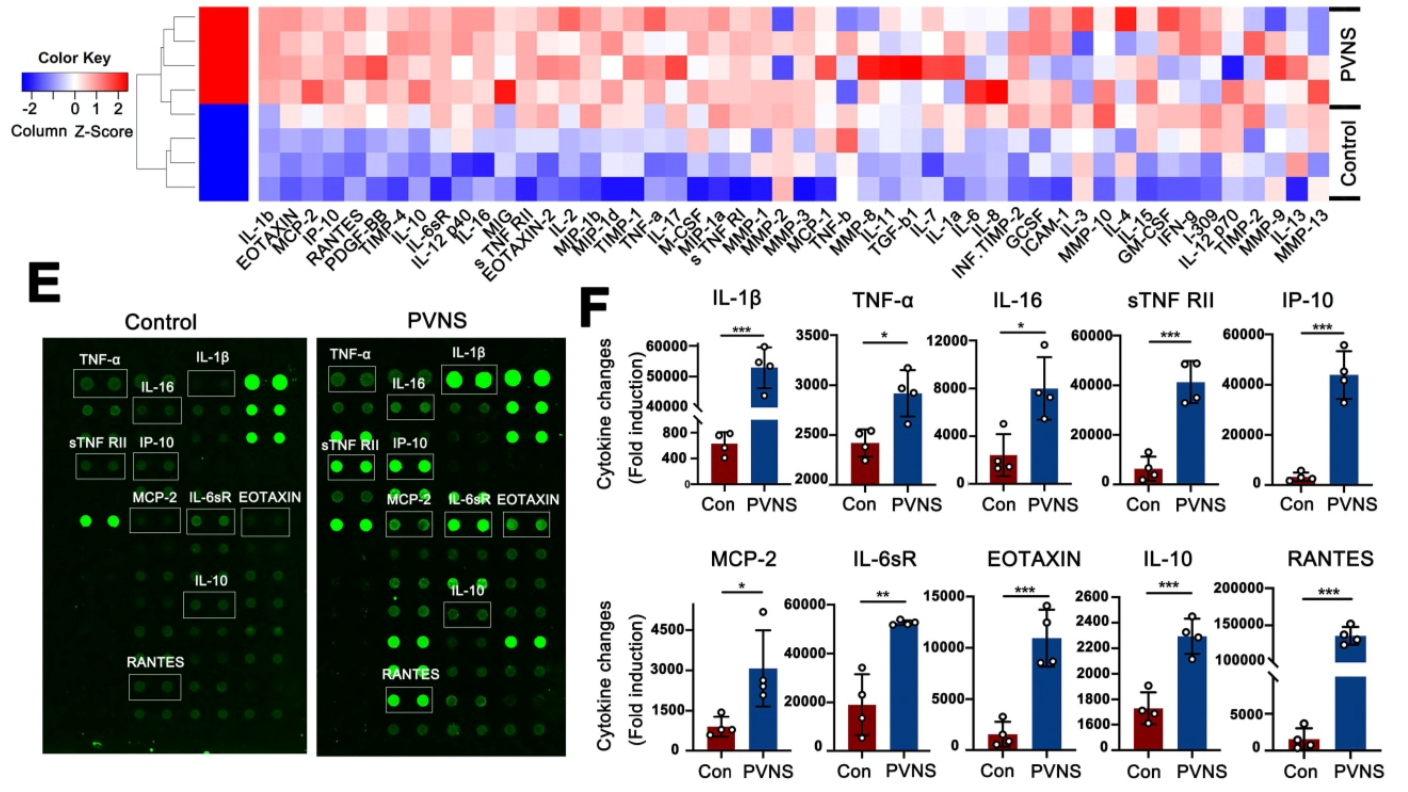
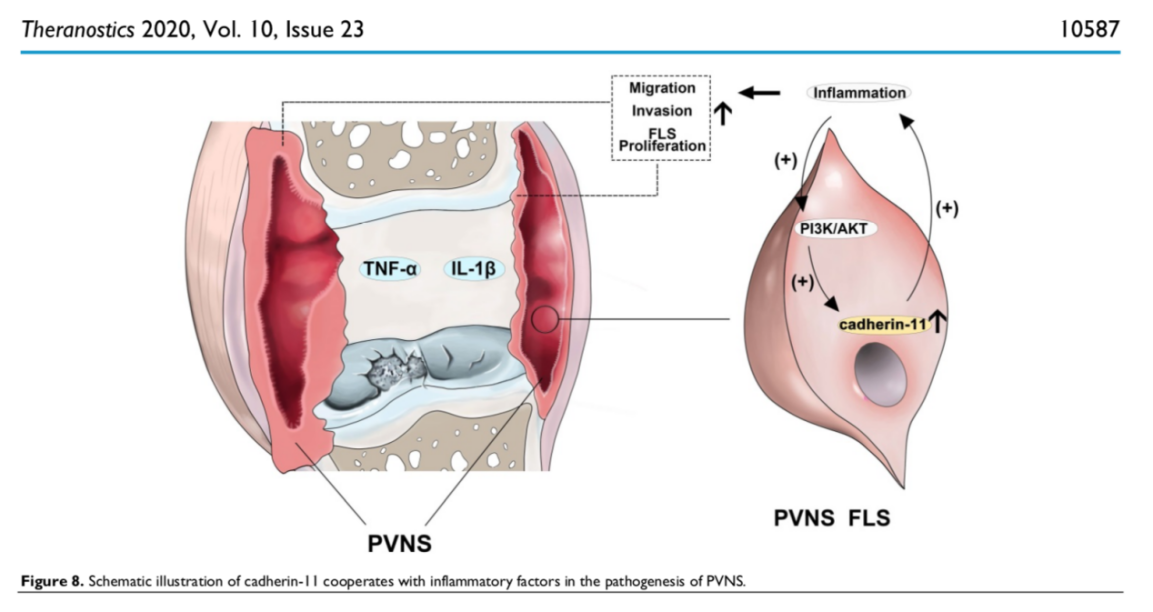
研究进一步深入研究了Cadherin-11与炎症因子在PVNS发病机制中的作用,发现Cadherin-11与炎性因子之间形成正反馈回路,并能协同激活PVNS FLS中NF-κB和MAPK通路,触发炎性瀑布效应,导致PVNS FLS和软骨细胞的共培养体系中软骨细胞出现退变,进而造成软骨损伤。在“炎症因子-Cadherin-11-炎症因子”的正反馈回路的不断刺激下,PVNS FLS的侵袭性和增殖逐渐失去控制,促进了PVNS从最初的炎性疾病向肿瘤性疾病的转化,造成其复发、关节外侵袭甚至恶变等临床表现,而敲低Cadherin-11的表达可以有效切断该正反馈循环,阻断炎性瀑布效应,抑制PVNS的疾病行为。本课题针对其发病机制进行基础研究与深入探索,国际上首次发现靶向精准基因治疗靶点Cadherin-11,对PVNS的发病机制研究和临床治疗有重大意义。
本文是敖英芳教授团队近期发表的又一篇高水平研究论文,研究所曹宸喜博士、吴菲博士与牛星跃博士为文章的并列第一作者,敖英芳教授、张辛副主任医师与胡晓青副研究员为共同通讯作者。
 科学研究
科学研究