2020年9月11日和11月11日,北京大学第三医院超声诊断科梁晓龙课题组相继在国际知名学术期刊ACS Nano上发表研究论文,报道在克服肿瘤乏氧提高化疗和光动力治疗疗效方面的最新研究进展。
研究进展一:开发一种“抗乏氧氟碳硅质体纳米粒”,用以实现氧气和化疗药物阿霉素(DOX)在肿瘤区域的定点可控递送
肿瘤复发转移是导致癌症死亡率居高不下的主要原因,肿瘤治疗不仅需要能够高效消除原位肿瘤,而且还应能有效抑制肿瘤复发和转移。乏氧是实体瘤最普遍的特征之一,它与肿瘤对各种疗法的抵抗性(包括化疗、光动力治疗等)密切相关。相对于化疗,乏氧可能导致肿瘤的多药耐药(MDR),最终还可能进一步导致化疗的失败。在MDR的发生过程中,肿瘤乏氧首先会提高肿瘤细胞的乏氧诱导因子-1α(HIF-1α)的相对表达水平,从而提高多药耐药基因1(MDR1)的转录水平,最终增加P-糖蛋白(P-gp)的蛋白表达水平,而P-gp作为多种化疗药物的“外排泵”,可以将进入肿瘤细胞内的药物泵回细胞外。因此,改善乏氧是增强化疗疗效的有效方法。尽管在临床上高压氧疗法可直接增加全身血液中的氧气浓度,但它缺少肿瘤特异性,并且存在高氧中毒的风险。此外,大部分已报道的氧气递送系统存在构建复杂、稳定性低、递氧效率不理想的问题。为此,北京大学第三医院超声诊断科梁晓龙课题组与北京大学医学同位素研究中心王凡教授课题组合作,开发了一种对高强度聚超声(HIFU)响应的超稳定“抗乏氧氟碳硅质体纳米粒”,用以实现氧气和化疗药物阿霉素(DOX)在肿瘤区域的定点可控递送。

该研究的特色主要体现在以下几方面:(1)采用高强度聚焦超声触发氧气从氟碳材料中释放。以往的报道使用近红外激光或普通超声触发氧气的释放,但是近红外激光的组织穿透性有限,普通超声没有升温效果,而肿瘤温度的升高可以加速血流灌注量,以进一步改善肿瘤乏氧。也就是说,高强度聚焦超声本身就具有一定程度上改善乏氧的能力。本研究证实,高强度聚焦超声可以缩小肿瘤乏氧区域的面积,降低HIF-1α的相对表达水平。(2)采用高稳定的硅质体作为氟碳材料的递送载体。以往报道中,与硅质体结构相似的脂质体氟碳递送载体在稳定性方面缺少优势。硅质体可以在氟碳材料表面形成一层有机硅氧烷网络结构,显著增加了结构稳定性和载药稳定性,使药物在体内的血液循环时间更长,肿瘤乏氧的改善程度更好,肿瘤生长的抑制效果更佳,并且药物的副作用更小。(3)通过改善乏氧进一步抑制乏氧介导的肿瘤转移。在以往的报道中,研究者借助各种各样的材料来改善肿瘤的乏氧,其主要目的在于提高化疗、放疗、光动力治疗等的疗效。而乏氧还和肿瘤的转移密切相关。本研究发现,通过携氧氟碳纳米硅质体联合HIFU可显著改善乏氧,降低转化生长因子-β(TGF-β)的表达量,抑制肿瘤细胞的上皮—间质转化,最终减少肿瘤转移。综上所述,与临床上使用的游离DOX和Doxil脂质体药物相比,利用该递送和控释策略可使肿瘤对DOX的摄取量大大增加,从而显著抑制肿瘤的生长和转移,展现出较好的临床应用前景。
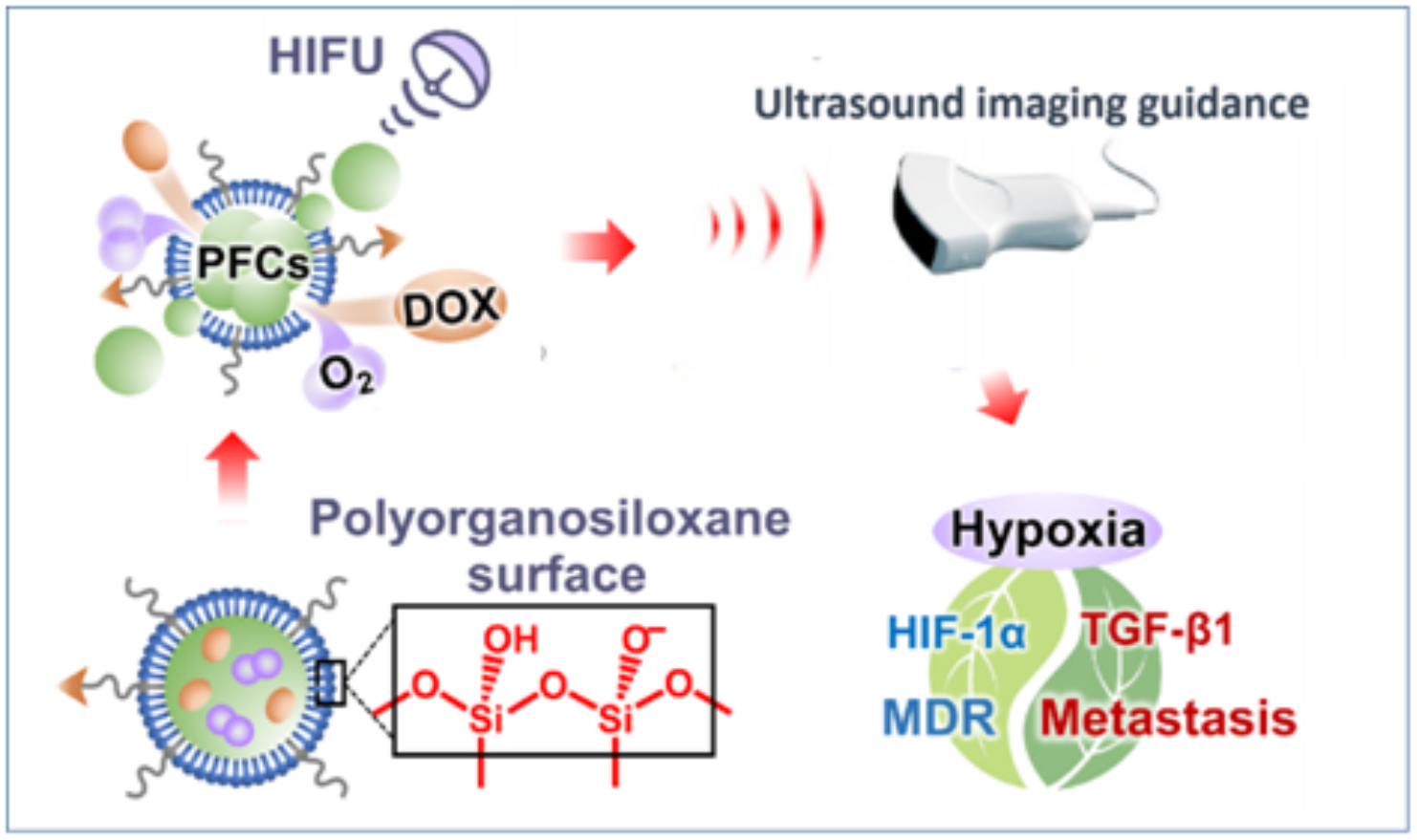
该研究近期在国际知名学术期刊ACS Nano上在线发表,题为“高强度聚焦超声响应的超稳定全氟化碳硅质体纳米液滴用于减轻肿瘤多药耐药和上皮-间充质转化”(High Intensity Focused UltrasoundResponsive and UltrastableCerasomalPerfluorocarbonNanodroplets for Alleviating Tumor Multidrug Resistance and Epithelial?Mesenchymal Transition)。北京大学第三医院超声诊断科联合培养博士生马晓途为该论文的第一作者,北京大学第三医院超声诊断科的梁晓龙副研究员和北京大学医学同位素研究中心的王凡教授为该论文的共同通讯作者。
研究进展二:研制了新型“抗乏氧卟啉-氟碳纳米粒”,有助于高效的实现光敏剂和氧气的同步输送
在光动力治疗方面,相比于手术、化疗和放疗等传统疗法,光动力疗法(Photodynamic Therapy,PDT)通过光敏剂将激光能量传递给氧分子产生活性氧从而杀死癌细胞,具有无创、无耐药性、副作用小等优点,已成为临床上癌症治疗的重要手段。然而,光敏剂在体内较低的输送效率,以及PDT对于氧气的高度依赖性使其对乏氧实体瘤的治疗效果十分有限。此外,肿瘤自身固有的乏氧微环境还将激活乏氧诱导因子HIF-1α,导致与肿瘤存活、增殖、代谢、血管生成、耐药等相关基因的上调,对癌症的治疗产生不利影响,并进一步引发肿瘤的复发转移。因此,如何高效地实现光敏剂和氧气的同步输送,从而改善疗效并抑制肿瘤复发转移,仍然是PDT在临床推广应用中面临的重要挑战。为此,北京大学第三医院超声诊断科梁晓龙课题组与北京大学工学院戴志飞教授课题组合作,研制了新型“抗乏氧卟啉-氟碳纳米粒”,很好地解决了上述问题。

该研究先以季戊四醇为骨架,设计合成了共价键连卟啉光敏剂的两亲性脂质分子PGL,并在该分子中引入了两条脂肪碳链,该结构可使所组装的纳米粒子中光敏剂的自聚集显著减少,从而显著提高光敏剂的荧光和单线态氧产生效率。此外,该颗粒内部的卟啉和碳链的强疏水作用可进一步装载携氧液态全氟溴辛烷(PFOB),从而获得卟啉和PFOB负载量分别高达38.5%和98.15%的卟啉氟碳纳米粒(O2@PFOB@PGL NPs)。该纳米粒子有效改善了光敏剂和氧气的肿瘤递送效率,通过在实现PDT过程中进行氧气自供应,避免了肿瘤乏氧的加剧。卟啉脂质分子和PFOB还可分别作为荧光和CT造影剂,实现纳米粒子的监测和肿瘤定位,引导激光准确照射肿瘤组织,实施PDT。实验结果表明,在HT-29结肠癌小鼠模型中,卟啉氟碳纳米粒可有效携载氧气,并通过被动靶向作用高效富集于肿瘤组织中,在不需要外界刺激的情况下,有效地向乏氧肿瘤中补充氧气,这一方面有助于PDT过程中单线态氧的产生,实现更彻底的PDT消除原位肿瘤;另一方面,也可有效缓解肿瘤的乏氧,降低HIF-1α和COX-2的表达,从而有效地抑制肿瘤肝转移的发生。
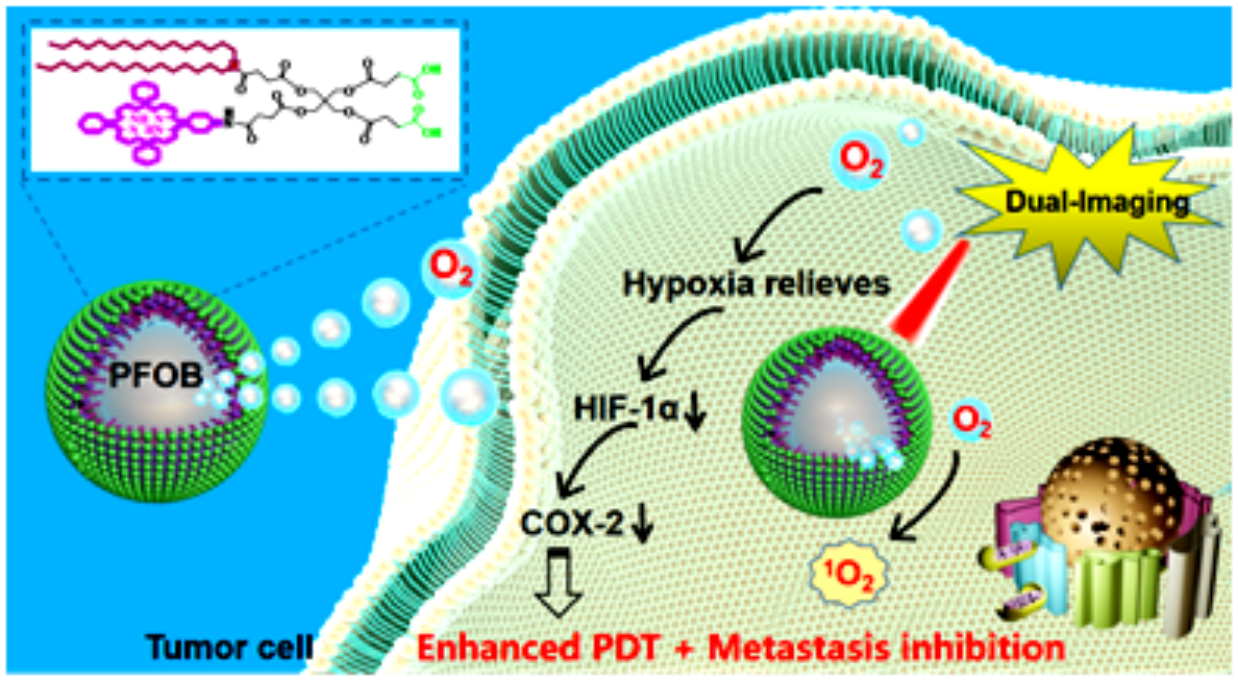
该研究近期在国际知名学术期刊ACS Nano上在线发表,题为“卟啉氟碳纳米粒抗肿瘤乏氧增效光动力治疗并抑制结肠癌肝转移”(Perfluorocarbon@PorphyrinNanoparticles for Tumor Hypoxia Relief to Enhance Photodynamic Therapy against Liver Metastasis of Colon Cancer)。北京大学第三医院超声诊断科的梁晓龙副研究员和北京大学工学院的陈敏博士为共同第一作者,北京大学工学院的戴志飞教授为通讯作者。
上述研究工作得到了科技部重点研发计划纳米科技专项、国家自然科学基金、北京市青年拔尖人才项目、北京大学第三医院人才项目的支持。
 科室新闻
科室新闻